Aufbau原理(定义,显著特征,个例,编写电子构型)
Release Time:2021-03-30什么是Aufbau原理?
Aufbau原理规定了电子在其基态下被填充到原子轨道中的方式。它指出,电子以轨道能级的递增顺序填充到原子轨道中。 根据Aufbau原理,具有最低能级的可用原子轨道要先于具有较高能级的原子轨道被占据。“ Aufbau”一词有德语渊源,可以粗略地翻译为“ construct”或“ build up”。 下面提供说明原子轨道填充顺序的图。 此处,“ n”是指主要量子数,“ l”是方位角量子数。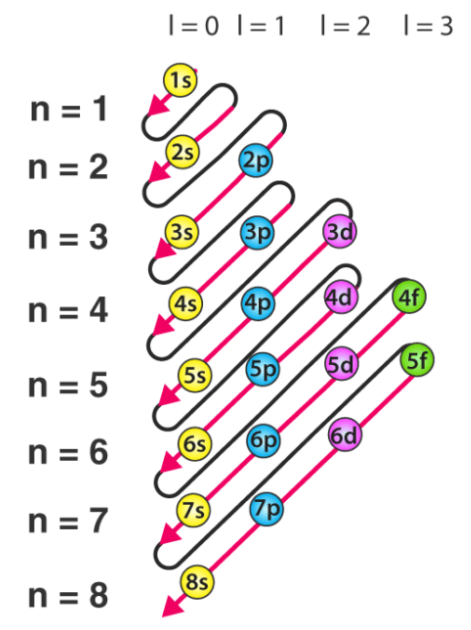
Aufbau原理可用于理解原子中电子的位置及其相应的能级。例如,碳有6个电子,其电子构型为1s22s22p2。重要的是要注意,每个轨道最多可以容纳两个电子(按照保利排除原理)。同样,在单个子壳中将电子填充到轨道中的方式必须遵循洪德规则,即,给定子壳中的每个轨道必须被任何两个电子配对之前先被电子单独占据。
Aufbau原理的显著特征:
根据Aufbau原理,电子首先占据能量最低的那些轨道。这意味着仅当具有较低能量的轨道被完全填充时,电子才进入具有较高能量的轨道。轨道能量的增加顺序可以借助(n + 1)规则确定,其中主量子数和方位量子数之和确定了轨道的能级。较低的(n + 1)值对应于较低的轨道能量。如果两个轨道共享相等的(n + 1)值,则称n值较低的轨道具有较低的能量。轨道充满电子的顺序为:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p,等等。
Aufbau原理的个例:
铬的电子构型为[Ar] 3d54s1,而不是[Ar] 3d44s2(由Aufbau原理提出)。此例外归因于几个因素,例如半填充子壳提供的更高的稳定性以及3d和4s子壳之间相对较低的能隙。下图显示了不同子壳之间的能隙: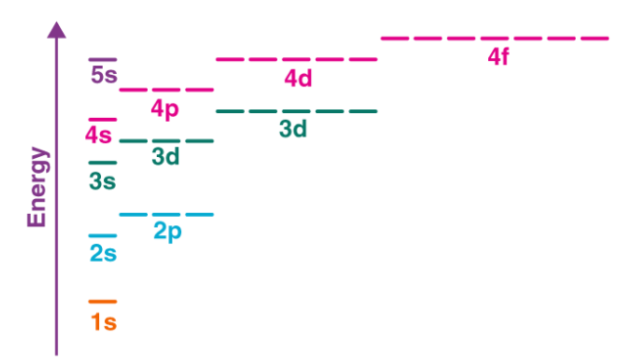
半填充子壳在轨道中具有较低的电子-电子排斥力,从而提高了稳定性。同样,完全填充的子壳也会增加原子的稳定性。因此,某些原子的电子构型违反了奥夫堡原理(取决于轨道之间的能隙)。例如,铜是该原理的另一个例外,其电子结构对应于[Ar] 3d104s1。这可以通过完全填充的3d子壳提供的稳定性来解释。
Aufbau原理编写电子构型:
使用Aufbau原理的电子配置
1.编写硫的电子构型 硫的原子数为16,这意味着它总共拥有16个电子。根据Aufbau原理,这些电子中的两个存在于1s子壳中,其中八个电子存在于2s和2p子壳中,其余电子分布在3s和3p子壳中。因此,硫的电子构型可以写为1s22s22p63s23p4。
2.编写氮的电子构型 氮元素具有7个电子(因为其原子序数为7)。电子被填充到1s,2s和2p轨道中。氮的电子构型可以写为1s22s22p3
Aufbau原理规定了电子在其基态下被填充到原子轨道中的方式。它指出,电子以轨道能级的递增顺序填充到原子轨道中。 根据Aufbau原理,具有最低能级的可用原子轨道要先于具有较高能级的原子轨道被占据。“ Aufbau”一词有德语渊源,可以粗略地翻译为“ construct”或“ build up”。 下面提供说明原子轨道填充顺序的图。 此处,“ n”是指主要量子数,“ l”是方位角量子数。

Aufbau原理可用于理解原子中电子的位置及其相应的能级。例如,碳有6个电子,其电子构型为1s22s22p2。重要的是要注意,每个轨道最多可以容纳两个电子(按照保利排除原理)。同样,在单个子壳中将电子填充到轨道中的方式必须遵循洪德规则,即,给定子壳中的每个轨道必须被任何两个电子配对之前先被电子单独占据。
Aufbau原理的显著特征:
根据Aufbau原理,电子首先占据能量最低的那些轨道。这意味着仅当具有较低能量的轨道被完全填充时,电子才进入具有较高能量的轨道。轨道能量的增加顺序可以借助(n + 1)规则确定,其中主量子数和方位量子数之和确定了轨道的能级。较低的(n + 1)值对应于较低的轨道能量。如果两个轨道共享相等的(n + 1)值,则称n值较低的轨道具有较低的能量。轨道充满电子的顺序为:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p,等等。
Aufbau原理的个例:
铬的电子构型为[Ar] 3d54s1,而不是[Ar] 3d44s2(由Aufbau原理提出)。此例外归因于几个因素,例如半填充子壳提供的更高的稳定性以及3d和4s子壳之间相对较低的能隙。下图显示了不同子壳之间的能隙:

半填充子壳在轨道中具有较低的电子-电子排斥力,从而提高了稳定性。同样,完全填充的子壳也会增加原子的稳定性。因此,某些原子的电子构型违反了奥夫堡原理(取决于轨道之间的能隙)。例如,铜是该原理的另一个例外,其电子结构对应于[Ar] 3d104s1。这可以通过完全填充的3d子壳提供的稳定性来解释。
Aufbau原理编写电子构型:
使用Aufbau原理的电子配置
1.编写硫的电子构型 硫的原子数为16,这意味着它总共拥有16个电子。根据Aufbau原理,这些电子中的两个存在于1s子壳中,其中八个电子存在于2s和2p子壳中,其余电子分布在3s和3p子壳中。因此,硫的电子构型可以写为1s22s22p63s23p4。
2.编写氮的电子构型 氮元素具有7个电子(因为其原子序数为7)。电子被填充到1s,2s和2p轨道中。氮的电子构型可以写为1s22s22p3




 购物车
购物车 



