路易斯酸( Lewis acid)类产品介绍(路易斯酸例子,路易斯酸与碱反应)
Release Time:2019-11-05一、路易斯酸介绍:
路易斯酸和碱通过路易斯酸碱反应理论描述为电子对受体和电子对给体。 因此,路易斯碱可以给路易斯酸提供一对电子,以形成含有配位共价键的产物。 该产物也称为路易斯加合物。 下面给出了详细说明路易斯酸和碱之间的反应,导致它们之间形成配位共价键的反应的图解。
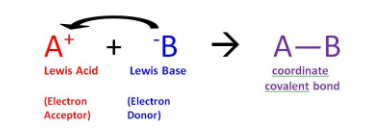
图例1
路易斯酸是具有空轨道并且能够接受来自路易斯碱的电子对的化学物质。该术语通常用于描述具有三角形平面结构和空p轨道的化学物质。这种路易斯酸的例子是BR3(其中R可以是卤化物或有机取代基)。水和其他一些化合物被视为路易斯酸和碱,因为它们可以根据反应接受和提供电子对
- 路易斯酸的例子
- H +离子(或质子)可以与路易斯离子(如H 3 O +)一起视为路易斯酸。
- 显示高氧化态的d嵌段元素的阳离子可以充当电子对受体。这种阳离子的一个例子是Fe 3+。
- 金属(例如Mg2 +和Li +)的阳离子可以与水作为配体形成配位化合物。这些水族络合物可以接受电子对,并表现为路易斯酸。
- H3C +和其他三角平面物质给出的碳正离子倾向于接受电子对。
- 以下15种元素的五卤化物可以充当路易斯酸-锑,砷和磷。
- 刘易斯基地
- 最常见的路易斯碱是氨,烷基胺和其他常规胺。通常,路易斯碱本质上是阴离子的,其碱强度通常取决于相应母体酸的pKa。
- 刘易斯基地的例子,下面列出了具有捐赠电子对能力的路易斯碱的实例。
- 吡啶和吡啶的衍生物具有充当电子对供体的能力。
- 氧,硫,硒和碲(属于元素周期表的第16组)的氧化态为-2的化合物通常是路易斯碱。这种化合物的例子包括水和酮。
- 具有电子对的简单阴离子也可以通过捐赠这些电子而充当路易斯碱。此类阴离子的例子包括H–和F–。甚至某些复杂的阴离子(例如硫酸根阴离子(SO42-))也可以提供电子对。
- 富含电子(例如苯,乙炔和乙烯)的π系统具有强大的电子对给体能力。
- 路易斯酸与碱之间的化学反应
- 与H +离子的反应

氧原子向质子提供电子对,从而在该过程中形成配位共价键。 所得的路易斯酸具有与其相关的+1电荷。 H +离子充当路易斯酸的反应的另一个例子是其与氨(NH3)的反应形成铵离子(NH4 +)。
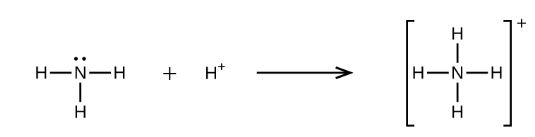
在该反应中,质子从氮原子(属于氨分子)接收电子对。 两者之间配位共价键的形成导致路易斯加合物(铵阳离子)的形成。
- Ag +与氨基之间的反应
该反应中氨充当路易斯碱,银离子充当路易斯酸。 每个氮原子向Ag +提供电子对,从而产生两个独立的配位共价键。 由路易斯酸和碱形成的加合物具有化学式Ag(NH3)2+。
- 氟离子与三氟化硼之间的反应
在此反应中,F–充当电子对供体,而BF3接受电子对。 路易斯酸与碱之间的反应导致形成化学式为BF4-的加合物。
- 路易斯酸和碱的应用
路易斯酸在Friedel-Crafts反应中起着至关重要的作用– AlCl3接受一个孤对电子,该电子对属于氯离子,导致AlCl4的形成–在Friedel-Crafts烷基化过程中。
这也导致形成高亲电性碳离子,该离子充当强路易斯酸。化学反应可以写成如下。
RCl + AlCl3?R + + AlCl4–
在有机化学领域中,路易斯酸被广泛用于促进许多阳离子或假阳离子化学反应。Lewis碱在改变金属催化剂的选择性和活性方面具有广泛的应用。对于药物的生产,不对称催化是对映选择性合成的重要组成部分。为了实现不对称催化,经常使用手性路易斯碱来赋予催化剂手性。
几种路易斯碱具有与路易斯酸形成许多键的能力。这些化合物也称为“多齿路易斯碱”或“螯合剂”,具有广泛的工业和农业应用。
- 路易斯酸常见的问题
吉尔伯特·刘易斯(Gilbert N. Lewis)在1923年提出了他对酸和碱的定义。根据这个定义,酸是电子对受体,而碱是电子对供体。
因此,路易斯酸可以定义为可以接受来自路易斯碱的一对电子并与其形成配位共价键的化学实体。路易斯碱可以定义为一种化学物种,其中占据最高的分子轨道(HOMO)高度集中,从而具有捐赠电子对的能力。
- 盐酸是否合格为路易斯酸?
由于不能接受电子对,盐酸通常被称为经典酸而不是路易斯酸。而且,当与路易斯碱反应时,HCl不会形成任何加合物。
- 哪些金属充当路易斯酸?
大多数金属离子与某些配体以协调结构存在。为了使路易斯碱给它们提供电子对,金属离子必须首先从配体上解离。由这些离子形成的路易斯加合物通常也是复合物。
- 常见的一些路易斯酸的列举:
- 通式为R-NH3的胺,例如甲胺。
- 氟离子(F–)
- 氨气(NH3)
- 水(H2O)
- 丙酮和许多其他酮。
- 硫属元素(氧,硫,硒和碲)的氧化态为-2的化合物通常充当路易斯碱。
因此,本文简要讨论了路易斯酸和碱的定义,化学行为及其应用。要了解有关酸和碱的定义以及其他相关主题的更多信息,




 购物车
购物车 



