HPLC和LC-MS缓冲液如何选择
Release Time:2020-06-17 当样品中含有可电离的化合物时,流动相的pH可以是以下一种反相保留控制中最重要的变量HPLC(RP-HPLC)分离。 但是,如果控制不当,pH值可能会降低。成为许多问题的根源。 由于大多数化合物是通过RP-HPLC分析的包含一个或多个酸性或碱性官能团,大多数流动相需要控制pH。 因此,缓冲器被广泛使用。
HLPC和LC-MS过程中为什么要控制pH值?
图1说明了当存在可电离化合物时需要控制pH。 当酸在其pKa之上或之下超过2个pH单位时,它将分别> 99%被电离或未被电离。 碱基在pKa以下被电离,在pKa以上未被电离。 非电离形式的极性较小(疏水性更高),因此在反相系统中的保留力更大。 因此,在低pH值下,酸将保留更多(图1a),而在高pH值下,碱将保留更多(图1b)。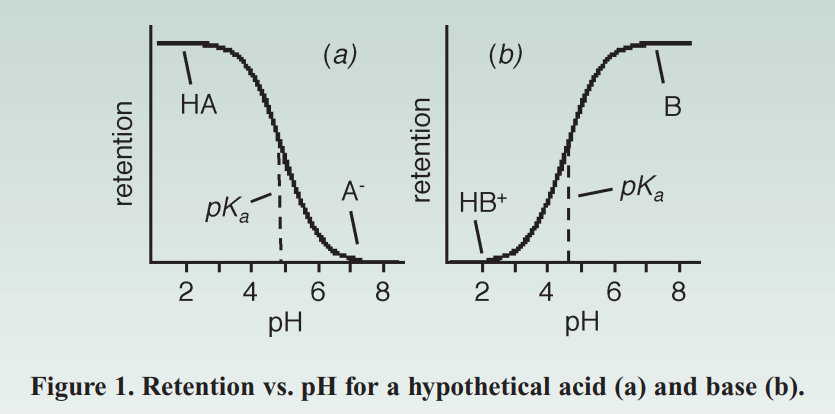
如果流动相的pH值接近pKa,则可以看到pH值的微小变化会导致保留率发生较大变化,而不是可靠分离的结果。图2a中对此进行了说明,该图显示了某些传感器的极端灵敏度。化合物的pH值变化很小。 在此,分辨率变化一个因素仅有0.1个pH单位的变化中有两个是-这是pH的误差量许多实验室共同进行的调整。 图2b表示酸,碱和中性化合物的保留时间与pH值的关系。 在pH5下,保留对pH的敏感性不如pH 3(对于酸)或pH≥6(对碱)敏感。
除了当pH值接近pKa时保留时间的不稳定性外,如果存在类似结构的化合物,则相对峰间距(选择性)也会改变。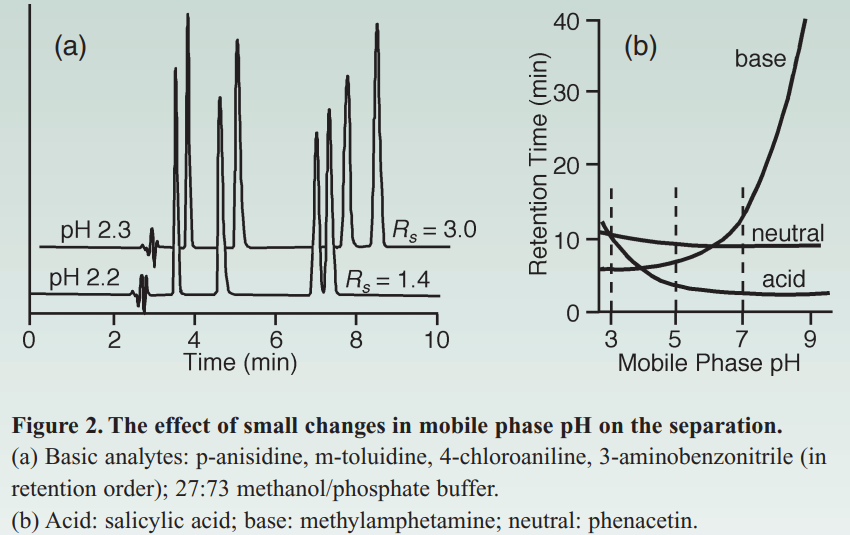
选择流动相pH时应考虑的另一个因素是色谱柱的稳定性。通常,基于硅胶的色谱柱应在2 <pH <8的条件下操作。在pH <2时,可能会发生由于水解引起的键合相损失。高于pH 8时,二氧化硅主链变得越来越可溶。高纯度二氧化硅往往比低纯度产品更能耐受高pH。进一步复杂的是未键合硅烷醇(-Si-OH)的电离潜力二氧化硅颗粒表面上的基团。对于较旧,纯度较低的二氧化硅(通常称为“ A型”二氧化硅),这些硅烷醇基团的pKa处于pH 4-5区域。这意味着在pH> 6时,这些化合物会发生显着的硅烷醇电离材料。从历史上看,这一直是导致基本通过阳离子交换过程的化合物。较新的高纯度(“ B型”)二氧化硅的pKa> 7,因此由于与离子化硅烷醇的位置极少。这是高纯度二氧化硅产生的原因之一如图所示,碱基的峰形比旧峰更好图3中所示的分离中,几个基本成分的变化很大。除了改善峰形外,使用高纯度二氧化硅还可以与低纯度硅胶相比,由于降低了这些不可预测的仲硅烷醇相互作用。
实际影响
色谱柱和样品的特征通常会导致建议以pH 2-3的流动相开始方法开发范围。在此pH值下,大多数有机酸的电离将被抑制,因为将使色谱柱上任何硅烷醇基团电离。碱将被离子化在这些条件下,但是大多数碱性化合物的pKa> 7,因此在足够高的pH值下抑制离子化将对大多数人有害列。因此,在所有其他条件相同的情况下,最好从低pH开始。如果您需要在高pH下操作色谱柱,请确保选择已知的色谱柱在所选的pH范围内保持稳定。
如果低pH离子抑制不能提供可接受的结果,则流动相可以调节pH以帮助获得所需的分离。通常是最调整流动相有机物含量(%B溶剂)获得丰硕成果对于中性和非电离化合物可接受的保留,然后调整pH值可微调离子分析物的保留。
控制pH
由于可电离化合物的保留对流动相非常敏感pH值,有必要通过添加流动相来控制流动相的pH值。缓冲。 当添加少量酸或碱时,缓冲液可保持pH值。HPLC中使用了许多不同的物质进行缓冲。 其中一些表1列出了各种添加剂。在±1 pH范围内使用时,缓冲液最有效单位pKa,但可以提供足够的pKa缓冲±2 pH单位。
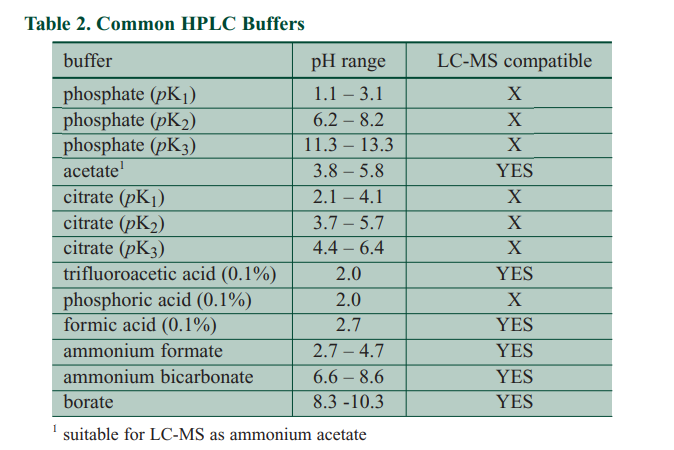
用于HPLC和UV检测的最受欢迎的缓冲液是磷酸盐和醋酸盐。磷酸盐和乙酸盐是特别有用的缓冲剂,因为它们可以在低于220 nm的波长下使用。从表2可以看出,磷酸盐具有三个pKa值,可为其提供三个缓冲范围:1.1 <pH <3.1,6.2 <pH <8.2,和11.3 <pH <13.3(允许缓冲pKa±1 pH单位)。色谱柱稳定性的实际限制要求我们将较低的范围截断为2.0 <pH <3.1并消除最高范围。请注意,在在磷酸盐的pH 3.1和pH 6.2之间缓冲。这意味着,尽管可以将磷酸盐的pH值调节到5.0,缓冲作用可以忽略不计在此pH下的容量。为了填补这一缓冲空白,需要另一个缓冲区。幸运的是,醋酸盐很好地满足了这一需求,缓冲范围为3.8 <pH <5.8。从pKa的±1 pH单位开始略微扩展缓冲范围,磷酸盐和乙酸盐可覆盖2 <pH <8的整个pH范围,通常用于硅胶柱有时,在方法开发过程中,您可能希望完全控制pH值超出了色谱柱的适用范围。 在这种情况下,磷酸盐的混合物
和醋酸盐缓冲液将使流动相从2 <pH <8。 一旦找到所需的pH,就可以消除不需要的缓冲液。例如,如果最终流动相的pH为4.3,则仅需乙酸盐,因此完全不需要使用磷酸盐。一些分析师喜欢将柠檬酸盐用作缓冲液,因为它具有三个重叠部分pKa值允许在2.1 <pH <6.4范围内缓冲(表2)。 然而,柠檬酸盐的紫外线截留率不如乙酸盐和磷酸盐低,因此在低于220 nm的波长是不可能的; 此外,一些分析师发现使用柠檬酸盐时,单向阀存在更多问题。 柠檬酸盐缓冲液通常是磷酸盐和乙酸盐的第二选择。
什么是LC-MS呢?
当质谱仪用作LC检测器(LC-MS)时,相位必须是易变的,因为LC-MS接口的功能之一是蒸发流动相。 这意味着LC-UV最受欢迎的缓冲液磷酸盐,不能使用。 醋酸铵的挥发性足以使用LC-MS,但我们将2.0 <pH <3.8和5.8 <pH <8.0覆盖。 表2列出了一些其他易失性的缓冲器LC-MS使用。 甲酸铵(2.7 <pH <3.7)的填充效果相当好低pH端的缺口。 碳酸氢铵(6.6 <pH <8.6)适用于较高的pH值。 这些不能完全覆盖所需的缓冲范围,但是对于LC-MS应用来说,它们是可以使用的。
只是对低pH感兴趣?
如果重要的是低pH的流动相,则0.1%v / v磷酸(表2)为LC-UV应用提供了在pH 2下的合理缓冲。三氟乙酸(TFA)在0.1%v / v时也会产生≈2的流动相pH(表2),并且多年来一直是低pH下LC-MS选择的添加剂。TFA也可作为离子对试剂,广泛用于蛋白质和肽分离。 但是,TFA可以抑制LC-MS中的电离接口,导致信号下降,因此近年来已不受欢迎。相反,0.1%甲酸(pH≈2.7,表2)是LC-MS的首选低pH。 对于低pH使用酸,可以认为pH更高比缓冲能力更重要–如果需要真正的缓冲,请选择一个表2中包含所需pH的缓冲液。
还是高pH值?
如前所述,二氧化硅的溶解度随着流动相pH值增加到pH 8以上而增加,因此通常不建议pH> 8。 但是,可能需要使用较高pH的流动相才能获得所需的分离效果。 在这种情况下,您应该选择专为在高pH下工作的色谱柱。 通常,高纯度二氧化硅,高“碳负荷”和封端会降低二氧化硅的溶解度。 应避免使用磷酸盐缓冲液,因为它会增加高pH下二氧化硅的溶解度。 取而代之的是使用有机缓冲液,例如吡咯烷,可以帮助延长高pH条件下的色谱柱寿命。 即使仔细选择条件,pH值> 8的色谱柱寿命也有望缩短。 当然,使用聚合而不是二氧化硅颗粒的色谱柱不易溶解于二氧化硅,因此可以在高pH下使用,但是这种色谱柱无法在固定相比硅胶色谱柱宽的范围内使用。
多少?
缓冲液的一项功能是将分析物保持在所需的pH值。 如果你仅考虑缓冲的这一方面,几乎不需要缓冲。 用于分析工作时,许多样品的浓度在µg / mL至ng / mL范围内。 所以对于<100的注射µL,柱上的质量将不超过几百纳克。 它需要即使从缓冲液的pKa到1 pH单位,缓冲液也很少,以提供所有样本所需的缓冲。
缓冲液还必须缓冲色谱柱,以使其保持恒定的pH。一个较大量的缓冲流动相通过色谱柱,因此固定相不断暴露于缓冲液中。新型高纯度二氧化硅
色谱柱具有较少的酸性硅烷醇基团,因此与较旧的低纯度硅胶柱。说明了该列的此属性图4的色谱图。(在本申请中,三氟乙酸既可以保持pH值低,又可以用作离子对试剂,所以两者效果不是彼此隔离的。)请注意色谱图表明,当三根色谱柱的峰形可比时将0.1%TFA添加到流动相中。但是,当浓度TFA下降了十倍,降至0.01%,如右图所示。图4二氧化硅纯度和峰形的相关性很明显。高峰相比之下,高纯度硅胶柱的形状稍有下降
TFA为0.1%时,中度和中等峰形发生了显着变化低纯度硅胶柱。两者之间唯一改变的变量套色谱图是TFA的浓度。看起来,TFA在起作用,至少部分地缓冲列,以使强大的交互作用峰拖尾最小化。当缓冲液不足时,峰形受累于所有列。尽管大多数新方法都是基于高纯度开发的,B型二氧化硅,硅烷醇酸度水平可能与一种制造商的产品到其他公司的产品。作为安全因素,使用超过所需的最小缓冲量。这导致我们建议使用约0.1%v / v范围内的酸添加剂或至少有至少15%的缓冲液最终解决方案中5-10 mM.
缓冲液的第三项也是最重要的任务是将样本缓冲后将其注入,使其迅速达到流动相pH。 应该很明显如果体积小,流动相缓冲器的工作就容易得多在与流动相相同的pH的进样溶剂中进样相相对于在具有pH与流动相明显不同。 一个可以克服的需求通过调整样品在流动相中获得高浓度的缓冲液注射前的pH值。
溶解度问题
我们只是在考虑是否需要有足够的缓冲液来缓冲样本,无论是在进样过程中还是在分离过程中,以及对色谱柱进行缓冲。另一方面,多少是太多?一个关键问题避免系统中的缓冲区沉淀。如果缓冲液沉淀在HPLC泵,清理工作可能很多,而且零件可能必须更换。但是,如果缓冲液沉淀在色谱柱内,则色谱柱应丢弃,因为几乎不可能从沉淀池中清洗沉淀出来的缓冲液固定相中的孔。正如大多数分析家所知,乙腈(ACN)是缓冲液中较差的溶剂和盐类比甲醇(MeOH)和四氢呋喃(THF)还要差。表3的数据说明了可溶性最低的通用缓冲区,磷酸钾,pH 7.0 [2]。当有机物含量为80%时,磷酸盐在在MeOH中浓度为15 mM,在ACN中浓度仅为5 mM;实际上是在80%THF中不溶(<5mM)。在含有50%有机物的流动相中,磷酸盐可溶于> 50 mM MeOH或ACN和25 mM THF。这表示使用高有机(%B)流动相进行等度分离的色谱柱梯度运行以高%B结尾,必须注意避免在可能发生缓冲沉淀。
HLPC和LC-MS过程中为什么要控制pH值?
图1说明了当存在可电离化合物时需要控制pH。 当酸在其pKa之上或之下超过2个pH单位时,它将分别> 99%被电离或未被电离。 碱基在pKa以下被电离,在pKa以上未被电离。 非电离形式的极性较小(疏水性更高),因此在反相系统中的保留力更大。 因此,在低pH值下,酸将保留更多(图1a),而在高pH值下,碱将保留更多(图1b)。

如果流动相的pH值接近pKa,则可以看到pH值的微小变化会导致保留率发生较大变化,而不是可靠分离的结果。图2a中对此进行了说明,该图显示了某些传感器的极端灵敏度。化合物的pH值变化很小。 在此,分辨率变化一个因素仅有0.1个pH单位的变化中有两个是-这是pH的误差量许多实验室共同进行的调整。 图2b表示酸,碱和中性化合物的保留时间与pH值的关系。 在pH5下,保留对pH的敏感性不如pH 3(对于酸)或pH≥6(对碱)敏感。
除了当pH值接近pKa时保留时间的不稳定性外,如果存在类似结构的化合物,则相对峰间距(选择性)也会改变。

选择流动相pH时应考虑的另一个因素是色谱柱的稳定性。通常,基于硅胶的色谱柱应在2 <pH <8的条件下操作。在pH <2时,可能会发生由于水解引起的键合相损失。高于pH 8时,二氧化硅主链变得越来越可溶。高纯度二氧化硅往往比低纯度产品更能耐受高pH。进一步复杂的是未键合硅烷醇(-Si-OH)的电离潜力二氧化硅颗粒表面上的基团。对于较旧,纯度较低的二氧化硅(通常称为“ A型”二氧化硅),这些硅烷醇基团的pKa处于pH 4-5区域。这意味着在pH> 6时,这些化合物会发生显着的硅烷醇电离材料。从历史上看,这一直是导致基本通过阳离子交换过程的化合物。较新的高纯度(“ B型”)二氧化硅的pKa> 7,因此由于与离子化硅烷醇的位置极少。这是高纯度二氧化硅产生的原因之一如图所示,碱基的峰形比旧峰更好图3中所示的分离中,几个基本成分的变化很大。除了改善峰形外,使用高纯度二氧化硅还可以与低纯度硅胶相比,由于降低了这些不可预测的仲硅烷醇相互作用。
实际影响
色谱柱和样品的特征通常会导致建议以pH 2-3的流动相开始方法开发范围。在此pH值下,大多数有机酸的电离将被抑制,因为将使色谱柱上任何硅烷醇基团电离。碱将被离子化在这些条件下,但是大多数碱性化合物的pKa> 7,因此在足够高的pH值下抑制离子化将对大多数人有害列。因此,在所有其他条件相同的情况下,最好从低pH开始。如果您需要在高pH下操作色谱柱,请确保选择已知的色谱柱在所选的pH范围内保持稳定。
如果低pH离子抑制不能提供可接受的结果,则流动相可以调节pH以帮助获得所需的分离。通常是最调整流动相有机物含量(%B溶剂)获得丰硕成果对于中性和非电离化合物可接受的保留,然后调整pH值可微调离子分析物的保留。
控制pH
由于可电离化合物的保留对流动相非常敏感pH值,有必要通过添加流动相来控制流动相的pH值。缓冲。 当添加少量酸或碱时,缓冲液可保持pH值。HPLC中使用了许多不同的物质进行缓冲。 其中一些表1列出了各种添加剂。在±1 pH范围内使用时,缓冲液最有效单位pKa,但可以提供足够的pKa缓冲±2 pH单位。
用于HPLC和UV检测的最受欢迎的缓冲液是磷酸盐和醋酸盐。磷酸盐和乙酸盐是特别有用的缓冲剂,因为它们可以在低于220 nm的波长下使用。从表2可以看出,磷酸盐具有三个pKa值,可为其提供三个缓冲范围:1.1 <pH <3.1,6.2 <pH <8.2,和11.3 <pH <13.3(允许缓冲pKa±1 pH单位)。色谱柱稳定性的实际限制要求我们将较低的范围截断为2.0 <pH <3.1并消除最高范围。请注意,在在磷酸盐的pH 3.1和pH 6.2之间缓冲。这意味着,尽管可以将磷酸盐的pH值调节到5.0,缓冲作用可以忽略不计在此pH下的容量。为了填补这一缓冲空白,需要另一个缓冲区。幸运的是,醋酸盐很好地满足了这一需求,缓冲范围为3.8 <pH <5.8。从pKa的±1 pH单位开始略微扩展缓冲范围,磷酸盐和乙酸盐可覆盖2 <pH <8的整个pH范围,通常用于硅胶柱有时,在方法开发过程中,您可能希望完全控制pH值超出了色谱柱的适用范围。 在这种情况下,磷酸盐的混合物
和醋酸盐缓冲液将使流动相从2 <pH <8。 一旦找到所需的pH,就可以消除不需要的缓冲液。例如,如果最终流动相的pH为4.3,则仅需乙酸盐,因此完全不需要使用磷酸盐。一些分析师喜欢将柠檬酸盐用作缓冲液,因为它具有三个重叠部分pKa值允许在2.1 <pH <6.4范围内缓冲(表2)。 然而,柠檬酸盐的紫外线截留率不如乙酸盐和磷酸盐低,因此在低于220 nm的波长是不可能的; 此外,一些分析师发现使用柠檬酸盐时,单向阀存在更多问题。 柠檬酸盐缓冲液通常是磷酸盐和乙酸盐的第二选择。

什么是LC-MS呢?
当质谱仪用作LC检测器(LC-MS)时,相位必须是易变的,因为LC-MS接口的功能之一是蒸发流动相。 这意味着LC-UV最受欢迎的缓冲液磷酸盐,不能使用。 醋酸铵的挥发性足以使用LC-MS,但我们将2.0 <pH <3.8和5.8 <pH <8.0覆盖。 表2列出了一些其他易失性的缓冲器LC-MS使用。 甲酸铵(2.7 <pH <3.7)的填充效果相当好低pH端的缺口。 碳酸氢铵(6.6 <pH <8.6)适用于较高的pH值。 这些不能完全覆盖所需的缓冲范围,但是对于LC-MS应用来说,它们是可以使用的。
只是对低pH感兴趣?
如果重要的是低pH的流动相,则0.1%v / v磷酸(表2)为LC-UV应用提供了在pH 2下的合理缓冲。三氟乙酸(TFA)在0.1%v / v时也会产生≈2的流动相pH(表2),并且多年来一直是低pH下LC-MS选择的添加剂。TFA也可作为离子对试剂,广泛用于蛋白质和肽分离。 但是,TFA可以抑制LC-MS中的电离接口,导致信号下降,因此近年来已不受欢迎。相反,0.1%甲酸(pH≈2.7,表2)是LC-MS的首选低pH。 对于低pH使用酸,可以认为pH更高比缓冲能力更重要–如果需要真正的缓冲,请选择一个表2中包含所需pH的缓冲液。

还是高pH值?
如前所述,二氧化硅的溶解度随着流动相pH值增加到pH 8以上而增加,因此通常不建议pH> 8。 但是,可能需要使用较高pH的流动相才能获得所需的分离效果。 在这种情况下,您应该选择专为在高pH下工作的色谱柱。 通常,高纯度二氧化硅,高“碳负荷”和封端会降低二氧化硅的溶解度。 应避免使用磷酸盐缓冲液,因为它会增加高pH下二氧化硅的溶解度。 取而代之的是使用有机缓冲液,例如吡咯烷,可以帮助延长高pH条件下的色谱柱寿命。 即使仔细选择条件,pH值> 8的色谱柱寿命也有望缩短。 当然,使用聚合而不是二氧化硅颗粒的色谱柱不易溶解于二氧化硅,因此可以在高pH下使用,但是这种色谱柱无法在固定相比硅胶色谱柱宽的范围内使用。
多少?
缓冲液的一项功能是将分析物保持在所需的pH值。 如果你仅考虑缓冲的这一方面,几乎不需要缓冲。 用于分析工作时,许多样品的浓度在µg / mL至ng / mL范围内。 所以对于<100的注射µL,柱上的质量将不超过几百纳克。 它需要即使从缓冲液的pKa到1 pH单位,缓冲液也很少,以提供所有样本所需的缓冲。
缓冲液还必须缓冲色谱柱,以使其保持恒定的pH。一个较大量的缓冲流动相通过色谱柱,因此固定相不断暴露于缓冲液中。新型高纯度二氧化硅
色谱柱具有较少的酸性硅烷醇基团,因此与较旧的低纯度硅胶柱。说明了该列的此属性图4的色谱图。(在本申请中,三氟乙酸既可以保持pH值低,又可以用作离子对试剂,所以两者效果不是彼此隔离的。)请注意色谱图表明,当三根色谱柱的峰形可比时将0.1%TFA添加到流动相中。但是,当浓度TFA下降了十倍,降至0.01%,如右图所示。图4二氧化硅纯度和峰形的相关性很明显。高峰相比之下,高纯度硅胶柱的形状稍有下降
TFA为0.1%时,中度和中等峰形发生了显着变化低纯度硅胶柱。两者之间唯一改变的变量套色谱图是TFA的浓度。看起来,TFA在起作用,至少部分地缓冲列,以使强大的交互作用峰拖尾最小化。当缓冲液不足时,峰形受累于所有列。尽管大多数新方法都是基于高纯度开发的,B型二氧化硅,硅烷醇酸度水平可能与一种制造商的产品到其他公司的产品。作为安全因素,使用超过所需的最小缓冲量。这导致我们建议使用约0.1%v / v范围内的酸添加剂或至少有至少15%的缓冲液最终解决方案中5-10 mM.
缓冲液的第三项也是最重要的任务是将样本缓冲后将其注入,使其迅速达到流动相pH。 应该很明显如果体积小,流动相缓冲器的工作就容易得多在与流动相相同的pH的进样溶剂中进样相相对于在具有pH与流动相明显不同。 一个可以克服的需求通过调整样品在流动相中获得高浓度的缓冲液注射前的pH值。
溶解度问题
我们只是在考虑是否需要有足够的缓冲液来缓冲样本,无论是在进样过程中还是在分离过程中,以及对色谱柱进行缓冲。另一方面,多少是太多?一个关键问题避免系统中的缓冲区沉淀。如果缓冲液沉淀在HPLC泵,清理工作可能很多,而且零件可能必须更换。但是,如果缓冲液沉淀在色谱柱内,则色谱柱应丢弃,因为几乎不可能从沉淀池中清洗沉淀出来的缓冲液固定相中的孔。正如大多数分析家所知,乙腈(ACN)是缓冲液中较差的溶剂和盐类比甲醇(MeOH)和四氢呋喃(THF)还要差。表3的数据说明了可溶性最低的通用缓冲区,磷酸钾,pH 7.0 [2]。当有机物含量为80%时,磷酸盐在在MeOH中浓度为15 mM,在ACN中浓度仅为5 mM;实际上是在80%THF中不溶(<5mM)。在含有50%有机物的流动相中,磷酸盐可溶于> 50 mM MeOH或ACN和25 mM THF。这表示使用高有机(%B)流动相进行等度分离的色谱柱梯度运行以高%B结尾,必须注意避免在可能发生缓冲沉淀。




 购物车
购物车 



