氘(氢的同位素)
Release Time:2022-01-24氢的同位素:
※ 氚
※ 氘
※ 氚
氢的三种同位素是已知的。 它们的原子序数为 1,质量数分别为 1、2 和 3。 这些研究所被称为 Hydrogen-1(氚)、Hydrogen-2(氘)和 Hydrogen-3(氚)。
它们的符号分别是1H1、1H2、1H3。 在化学方程式中,它们分别代表 H、D 和 T。 它们各有一个电子和一个质子,中子数分别为0、1、2。
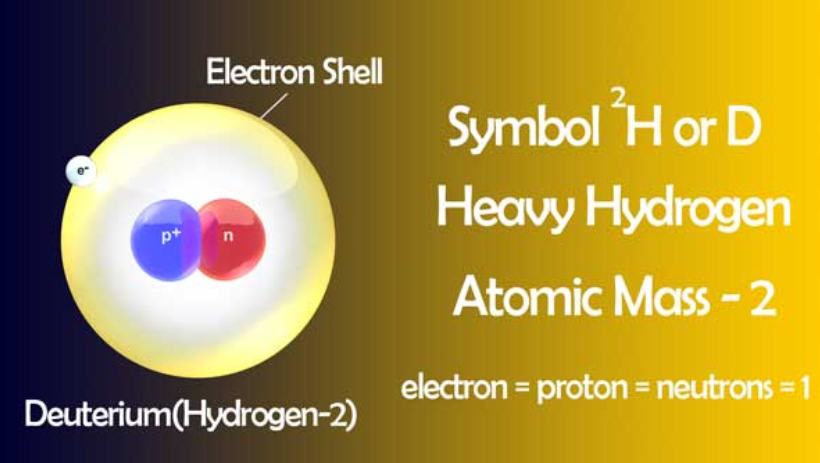
氘也称为轻氢,氘也称为重氢。 氢的所有三个位点,只有氕和氘是稳定的。 氚是暂时的。 它是氢的放射性同位素。 其半衰期为 12.32 年。
普通氢含有 99.98% 的氕、0.02% 的氘和几乎可以忽略不计的氚。 因此,大约 1000 份的普通氢含有大约 1 份的重氢。
氘:
像氢一样,氘在一个原子中有两个原子。 因此,它是一种双重标准气体。 Harold Urey 于 1931 年被发现。由于氘的发现,Harold Urey 于 1934 年获得诺贝尔奖。
氘制备:
重水:
氘的氧化物 (D2O) 也称为重水。 氘制重水的主要方法如下:
1)氘由重水中的钠作用而得。 得到氘气。
2Na + 2D2O → 2NaOD + D2
2)重水的电分解也产生二重气体。 为分解重水,加入少量五氧化二磷或碳酸钠。 并使用镍电极。
2D2O → 2D2 + O2
3) 当重水蒸气流过血液加热的铁、锌或镁金属时,也会产生二重气体。
2Fe + 4D2O → Fe3O4 + 4D2
Zn + D2O → ZnO + D2
Mg + D2O → MgO + D2
上述反应既可用于在实验室制造少量二重奏气体,也可用于工业制造。
氢
大约 6,000 份普通氢含有大约 1 份氘。 以下是从普通氢中分离二重奏的主要方法。
※ 扩散法:
根据格雷厄姆扩散定律,气体的扩散速度与其原子质量的平方根成反比。
r ∞ 1/√M
因此,轻气体比重气体膨胀得更快。 通过将普通氢膨胀到多孔罐中,轻氢会迅速膨胀。 因此可以获得二重气体。
※ 分馏法:
在这种方法中,液态氢在真空中被有效地蒸馏。 轻氢(沸点 = 20.28 K)首先蒸发,氘(沸点 = 23.59 K)留在蒸馏瓶中。 Harold Urey 于 1931 年首次使用这种方法。
※ 物理性质:
它是一种无色、无臭、无味的气体。 它不溶于水。 它的重量和密度是氢的重量和密度的两倍。 它的沸点是 23.59 K。
氢同位素化学性质:
同位素的化学性质相似。 因此,氘和氢也具有相似的性质。 氘和氢的化学反应速度不同。 氢的化学反应大约是氘化学反应的两倍。 以下是它的一些关键化学反应。
※ 燃烧:
它形成与空气一起燃烧的重水。
2D2 + O2 → 2D2O
※ 氢同位素与卤素反应:
Duetro-Halides 是通过与适当位置的卤素作用形成的。
D2 + F2 – 低温/黑暗 → 2DF
D2 + Cl2 – 阳光 → 2DCl
D2 + Br2 -4000C→ 2DBr
D2 + I2 – Pt → 2DI
※ 氢同位素与氮反应:-
3D2 + N2 –Fe+Mo → 2ND3(氘代氨)
※ 氢同位素与硫反应:
D2 + S – 高温 → D2S(硫化氘)
※ 氢同位素于金属反应:
2Na + D2 – 3500C → 2NaD(氘化钠)
Ca + D2 – 4000C → CaD2 (氘化钙)
※ 氢同位素反应总结:
它表现出与不饱和烃的总结反应。

※ 氢同位素交流反应:
在合适的条件下,它用氘取代氢化合物中的氢。 这种反应称为交换反应。

氘的用途:
※ 它被用作核反应中的射弹和核聚变过程中的反应堆。
※ 它用于制造氘的化合物。
※ 在研究各种反应和过程的过程中用作示踪元素。
※ 用于制造重水,在核裂变过程中用作慢化剂。
tags:氘,氘水,氘的反应




 购物车
购物车 



