价键理论(定义,历史,假设,轨道数和杂交类型,应用,局限性)
Release Time:2021-04-02什么是价键理论?
已经提出了许多方法来解释配位化合物中键的性质。其中之一是价键理论。价键理论的发展是为了解释使用量子力学方法的化学键。该理论主要集中于在分子形成过程中由参与原子的原子轨道形成单个键。根据价键理论,分子中的电子占据原子轨道,而不是分子轨道。原子轨道在键形成上重叠,并且重叠越大,键越牢固。金属键的起源基本上是共价的,金属结构涉及每个原子与其相邻原子之间电子对键的共振。
价键理论的历史:
路易斯的化学键合方法未能阐明化学键的形成。 此外,价壳电子对排斥理论(或VSEPR理论)具有有限的应用(并且在预测与复杂分子相对应的几何结构方面也失败了)。为了解决这些问题,德国物理学家沃尔特·海因里希·海特勒和弗里茨·沃尔夫冈·伦敦提出了价键理论。 Schrodinger波动方程还用于解释两个氢原子之间共价键的形成。 根据价键理论,两个氢原子的化学键如下所示。
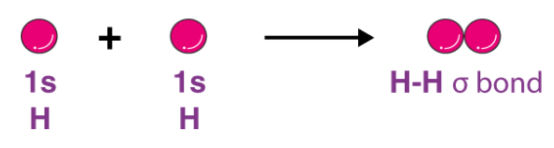 该理论侧重于电子构型,原子轨道(及其重叠)和这些原子轨道的杂化的概念。化学键由原子轨道的重叠形成,其中电子位于相应的键区域中。价键理论还继续解释了由原子轨道的这种重叠形成的分子的电子结构。它还强调了一个分子中一个原子的原子核被另一原子的电子吸引。
该理论侧重于电子构型,原子轨道(及其重叠)和这些原子轨道的杂化的概念。化学键由原子轨道的重叠形成,其中电子位于相应的键区域中。价键理论还继续解释了由原子轨道的这种重叠形成的分子的电子结构。它还强调了一个分子中一个原子的原子核被另一原子的电子吸引。
价键理论的假设:
价键理论的重要假设如下:
当属于两个不同原子的两个价原子轨道(半填充)相互重叠时,就会形成共价键。由于该重叠,两个键合原子之间的区域中的电子密度增加,从而提高了所得分子的稳定性。原子的价壳中存在许多不成对的电子,使其能够与其他原子形成多个键。根据价键理论,存在于价壳中的成对电子不参与化学键的形成。共价化学键是方向性的,并且还平行于与重叠的原子轨道相对应的区域。Sigma键和pi键的不同之处在于原子轨道重叠的方式,即pi键由侧向重叠形成,而沿包含两个原子核的轴的重叠导致形成σ键。sigma和pi键的形成如下所示:可以注意到,sigma键涉及原子轨道的头对头重叠,而pi键涉及平行的重叠。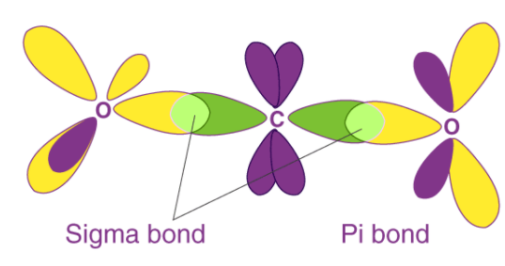
价键理论的轨道数和杂交类型:
根据VBT理论,金属原子或离子在配体的影响下可以使用其(n-1)d,ns,np或ns,np,nd轨道进行杂交,以产生一组具有确定几何形状的等效轨道,例如八面体 ,四面体,方形平面等。 这些杂化轨道被允许与配体轨道交叠,该配体轨道可以捐赠电子对用于键合。
价键理论的应用:
由价键理论描述的最大重叠条件可以解释几个分子中共价键的形成。这是其最重要的应用程序之一。例如,H 2和F 2分子中化学键的长度和强度的差异可以通过这些分子中重叠轨道的差异来解释。HF分子中的共价键由氢原子的1s轨道和属于氟原子的2p轨道重叠形成,这由价键理论解释。
价键理论的局限性:
1.无法解释碳表现出的四价态。
2.没有关于电子能量的见解。
3.该理论假设电子位于特定区域。
4.它没有给出配位化合物的热力学或动力学稳定性的定量解释。
5.弱配体和强配体之间没有区别。
6.没有解释配位化合物显示的颜色。
已经提出了许多方法来解释配位化合物中键的性质。其中之一是价键理论。价键理论的发展是为了解释使用量子力学方法的化学键。该理论主要集中于在分子形成过程中由参与原子的原子轨道形成单个键。根据价键理论,分子中的电子占据原子轨道,而不是分子轨道。原子轨道在键形成上重叠,并且重叠越大,键越牢固。金属键的起源基本上是共价的,金属结构涉及每个原子与其相邻原子之间电子对键的共振。
价键理论的历史:
路易斯的化学键合方法未能阐明化学键的形成。 此外,价壳电子对排斥理论(或VSEPR理论)具有有限的应用(并且在预测与复杂分子相对应的几何结构方面也失败了)。为了解决这些问题,德国物理学家沃尔特·海因里希·海特勒和弗里茨·沃尔夫冈·伦敦提出了价键理论。 Schrodinger波动方程还用于解释两个氢原子之间共价键的形成。 根据价键理论,两个氢原子的化学键如下所示。
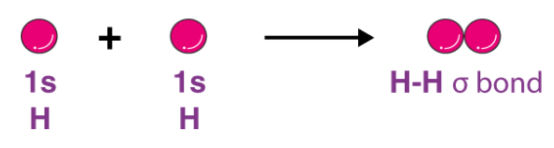
价键理论的假设:
价键理论的重要假设如下:
当属于两个不同原子的两个价原子轨道(半填充)相互重叠时,就会形成共价键。由于该重叠,两个键合原子之间的区域中的电子密度增加,从而提高了所得分子的稳定性。原子的价壳中存在许多不成对的电子,使其能够与其他原子形成多个键。根据价键理论,存在于价壳中的成对电子不参与化学键的形成。共价化学键是方向性的,并且还平行于与重叠的原子轨道相对应的区域。Sigma键和pi键的不同之处在于原子轨道重叠的方式,即pi键由侧向重叠形成,而沿包含两个原子核的轴的重叠导致形成σ键。sigma和pi键的形成如下所示:可以注意到,sigma键涉及原子轨道的头对头重叠,而pi键涉及平行的重叠。

价键理论的轨道数和杂交类型:
根据VBT理论,金属原子或离子在配体的影响下可以使用其(n-1)d,ns,np或ns,np,nd轨道进行杂交,以产生一组具有确定几何形状的等效轨道,例如八面体 ,四面体,方形平面等。 这些杂化轨道被允许与配体轨道交叠,该配体轨道可以捐赠电子对用于键合。
| Coordination Number | Type of Hybridisation | Distribution of Hybrid Orbitals in Space |
| 4 | sp3 | Tetrahedral |
| 4 | dsp2 | Square planar |
| 5 | sp3d | Trigonal bipyramidal |
| 6 | sp3d2 | Octahedral |
| 6 | d2sp3 | Octahedral |
价键理论的应用:
价键理论的局限性:
1.无法解释碳表现出的四价态。
2.没有关于电子能量的见解。
3.该理论假设电子位于特定区域。
4.它没有给出配位化合物的热力学或动力学稳定性的定量解释。
5.弱配体和强配体之间没有区别。
6.没有解释配位化合物显示的颜色。




 购物车
购物车 



