PMSF(苯甲基磺酰氟)
Release Time:2022-09-30PMSF(苯甲基磺酰氟)简介:
※ PMSF(苯甲基磺酰氟)是一种不可逆的丝氨酸蛋白酶抑制剂,用于各种研究和实验室过程中。PMSF在室温下呈白色粉末状外观,
※ PMSF熔点:在 90-95°C 之间。它通过抑制丝氨酸蛋白酶(如胰蛋白酶、糜蛋白酶和凝血酶)和半胱氨酸蛋白酶(如木瓜蛋白酶)发挥作用。该过程涉及通过酯化使活性位点上含有丝氨酸的酶失活。
了解 PMSF
※ PMSF(苯甲基磺酰氟)是一种不可逆的丝氨酸蛋白酶抑制剂,它通过抑制丝氨酸蛋白酶(如胰蛋白酶、糜蛋白酶和凝血酶)和半胱氨酸蛋白酶(如木瓜蛋白酶)发挥作用。该过程涉及通过酯化使活性位点上含有丝氨酸的酶失活。丝氨酸蛋白酶天然存在于所有生物体中,并负责广泛的生物过程。例如,胰蛋白酶和弹性蛋白酶充当胰腺消化酶,而溶纤蛋白影响细胞转化。
※ PMSF 等化合物可以通过防止蛋白酶的酶促功能帮助研究人员保存实验室的纯细胞样本。这种抑制剂的溶解度有限,需要研究人员在使用前将化合物溶解在乙醇、甲醇或异丙醇等溶剂中。因此,它可以作为水溶性蛋白酶抑制剂如 AEBSF(4-苯磺酰氟盐酸盐)的替代品。由于其半衰期短(通常仅在细胞裂解和纯化的第一步之间持续),研究人员可能会考虑应用其他蛋白酶抑制剂来延长酶的生物活性以满足他们的研究需要。
PMSF常见应用
1. 细胞裂解物的制备
裂解是一个涉及细胞膜分解的过程,可以促进对细胞成分的详细研究。裂解的结果称为裂解物。研究人员研究了 PMSF 作为酶活性的诱导剂,以刺激真菌物种(Daedaleopsis confragosa 和 D. tricolor)对木材降解(樱桃木屑)的刺激。该研究表明,在木质素分解酶的情况下,PMSF 在裂解制剂中的重要作用。 PMSF 可以帮助研究人员准确地制备细胞裂解物,确保酶促反应不会通过裂解物缓冲液相互作用而损害靶蛋白。例如,科学家经常将 PMSF 添加到裂解缓冲液中,以从大肠杆菌中制备细胞裂解液。研究人员将 PMSF 应用于 Sofalcone 的研究,Sofalcone 是一种合成查尔酮,用作胃粘液的保护剂。该团队将 PMSF 包括在裂解液缓冲液、组织提取物、组织裂解物和组织核提取物的制备中。 PMSF 的使用使研究人员发现了该药物与 KEAP1 蛋白结合的功能,从而产生抗结肠炎作用。
2. 样品保存
PMSF 用于在裂解后使特定蛋白质失活,以提供溶解的研究样品。这种抑制剂的非特异性使研究人员能够将该化合物应用于各种研究。例如,科学家们使用 PMSF 浓度来研究 anandamide 在模拟大麻活动小鼠模型中的作用。研究人员发现 PMSF 阻断了大麻中的主要精神成分 anandamide 的代谢功能。 PMSF 为研究人员提供了访问目标化合物的途径。在另一个例子中,研究人员研究了导致保存的海水样本中细菌流失的因素。通过将 PMSF 添加到戊二醛(实验中使用的防腐剂)中,科学家们发现在 30-35 天内减少了细菌的损失。该实验支持 PMSF 在保存戊二醛保存样品中的细菌方面的作用。
3. 蛋白质纯化
生物蛋白质的细胞水平在其自然状态或温和的环境条件下是稳定的。体外研究和实验将破坏蛋白质的细胞力学,导致降解和变性。蛋白酶抑制剂(如 PMSF)将通过减轻酶促反应在研究期间保持蛋白质稳定或纯化。具体而言,在裂解过程中,细胞/细胞器可能会面临通常抑制蛋白酶反应的调节机制的破坏。该反应通过蛋白水解导致各种蛋白质的分解。结果,研究人员可能会在该过程中丢失感兴趣的蛋白质,这会影响他们发现的准确性。研究人员通常将 PMSF 和 AEBSF 应用于蛋白质纯化过程,因为细胞和组织中的大多数蛋白酶属于丝氨酸蛋白酶组。因此,PMSF 是基于丝氨酸实验的裂解缓冲液中的重要组成部分。 PMSF 的加入减少了由于酶反应引起的样品污染,并为研究人员提供了更高浓度的功能性蛋白质。
采购优质试剂和化合物
研究人员可以将 PMSF 添加到抑制剂混合物或蛋白酶抑制剂混合物中,为裂解物样品提供全面的保护,使其免受所有四种催化蛋白酶的酶促作用:丝氨酸、半胱氨酸、天冬氨酸和金属。
PMSF 案例:
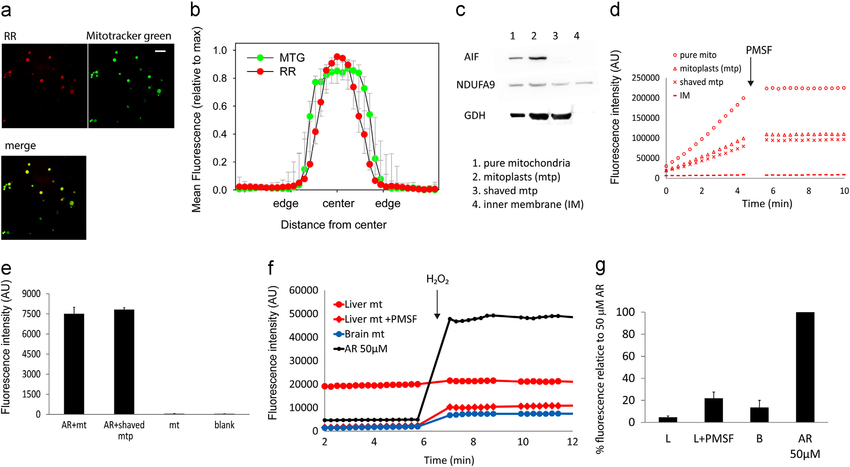
PMSF-sensitive conversion of AR to resorufin occurs in the mitochondrial matrix. (a) Confocal images of isolated liver mitochondria (average intensity projections of 10 Â 0.1 μM confocal planes captured at 1 Airy unit) showing resorufin and Mitotracker Green fluorescence. Resorufin fluorescence can be seen throughout the mitochondria matrix. Scale bar is 5 mM. (b) Mean line profile intensities of resorufin (RR) fluorescence through the central plane image of intact mitochondria after normalising both intensity (maxima ¼1) and size (edges and centre defined to set all objects to an equal, arbitrary diameter). N ¼ 13. Full width half maximum of the resorufin distribution is smaller than that of Mitotracker Green (MTG, p o 0.001, paired t test). (c) Western blots of mitochondrial subfraction marker proteins. AIF, apoptosis inducing factor; NDUFA9, NADH dehydrogenase 1 alpha subcomplex 9 (a component of complex I in the inner membrane); GDH, glutamate dehydrogenase. (d) Representative traces of resorufin fluorescence following incubation of the indicated liver mitochondrial subfraction with AR in the absence of HRP or substrate. All reactions are PMSF sensitive. (e) Resorufin fluorescence measured after incubation of intact liver mitochondria with AR for 10 min. Fluorescence (no PMSF, no further AR) was measured from intact mitochondria (ARþ mt) and after removing the outer membrane and intermembrane space (ARþ shaved mtp). Controls were mitochondria incubated without AR (mt) and blanks. Data are mean 7 SD, n¼ 3. (f) Representative traces of resorufin fluorescence in assay medium containing AR-pre-incubated liver (red circle) or brain (blue circle) mitochondria as only source of AR. Liver mitochondria were pre-treated (red diamonds) or not (red circle) with PMSF. 50mM AR without mitochondria was used as positive control. 49 pmole H 2 O 2 were added at the indicated time point. (g) Quantification of the experiment in f. Data are mean7 SD, n¼ 4. All values are significantly above 0 (Po 0.05, t-test). (For interpretation of the references to colour in this figure legend, the reader is referred to the web version of this article.)
相关文章:
※ PMSF蛋白酶抑制剂使用中的常见问题




 购物车
购物车 



